
Dalam kehidupan sehari-hari, manusia akan selalu bersentuhan dengan gas yang ada di sekitarnya. Dalam sains, gas dianggap ideal, yaitu fluida yang bergerak yang akan segera menempati ruangnya secara merata. Perilaku gas ketika mereka berada dalam suatu sistem dipelajari dalam teori kinetik gas.
Definisi Teori Kinetik Gas
Teori kinetik gas menyediakan jembatan untuk meninjau karakteristik gas baik secara makroskopis maupun mikroskopis. Kata kinetik menunjukkan bahwa molekul atau partikel gas akan selalu bergerak.
Hal ini menunjukkan bahwa ketika gas menempati ruang akan bergerak secara acak ke segala arah. Besaran makroskopis yang dimiliki oleh gas meliputi suhu, volume, dan tekanan. Semua kuantitas makroskopis ini dapat diukur di laboratorium.
Sedangkan besaran mikroskopis gas terdiri dari momentum molekul, kecepatan molekul, dan energi kinetik molekul. Besaran mikroskopis tidak dapat diukur secara langsung hanya di laboratorium tetapi besaran mikroskopis dapat dihitung.
Gas yang umum dipelajari adalah hukum gas ideal yang persis memenuhi hukum gas. Gas ideal sendiri merupakan gambaran gas yang sesuai dengan teori, sedangkan dalam kehidupan sehari-hari tidak ada gas yang memenuhi ciri-ciri gas ideal.
Beberapa ciri gas ideal adalah partikel gas tersebar merata di dalam ruangan dan bergerak secara acak ke segala arah.
Dalam teori kinetik gas dikatakan bahwa dalam sistem panas, partikel gas akan bergerak lebih cepat sehingga memiliki energi yang lebih besar daripada partikel gas dalam sistem dengan temperatur lebih rendah.
Postulat Teori Kinetik Gas
Gas ideal adalah kumpulan partikel suatu zat yang jarak partikelnya cukup jauh dibandingkan dengan ukuran partikel gas tersebut. Partikel dalam gas ideal dirumuskan dengan postulat teori kinetik gas sebagai berikut:
- Partikel dalam gas ideal selalu bergerak secara acak ke berbagai arah
- Partikel-partikel gas ideal akan saling bertumbukan baik antar partikel maupun bertumbukan dengan dinding, akan tercipta tumbukan lenting sempurna yang membuat gas ideal tidak kehilangan energi.
- Partikel gas ideal banyak
- Antar partikel gas tidak mengalami interaksi atau tidak menimbulkan gaya tarik menarik antar partikel
- Ukuran partikel gas ideal yang sangat kecil dibandingkan dengan ukuran ruangan dapat diabaikan
- Partikel gas ideal tersebar merata di dalam ruangan
- Hukum gerak Newton berlaku untuk gerak kinetik gas
- Energi kinetik rata-rata molekul gas ideal sebanding dengan suhu absolut gas ideal
Faktor dan Rumus Teori Kinetik Gas
- Tekanan
Tekanan gas dalam suatu sistem dapat diubah dengan mengatur volume dan suhu sistem. Hubungan antara tekanan, suhu dan volume dapat dilihat dari penggunaan alat masak Preswere Cooler (Presto).
Presto memasak makanan dengan memanfaatkan tekanan gas didalamnya yang diatur oleh suhu dan volume gas. Mengenai tekanan gas, hal ini dijelaskan dalam hukum Boyle – Guy Lussac. Boyle meneliti kondisi tekanan dan volume gas dengan menjaga agar suhu gas tetap konstan.
Dari hasil penelitian diketahui bahwa semakin besar tekanan gas maka volume gas semakin kecil. Sebaliknya, ketika volume meningkat, tekanan gas menurun. Sehingga dapat dirumuskan bahwa pada temperatur konstan, tekanan gas berbanding terbalik dengan volumenya.
PV = tetap
Sedangkan Guy Lussac meneliti bahwa jika gas memiliki tekanan konstan, maka nilai volume berbanding lurus dengan suhunya. Ketika suhu meningkat, volume juga meningkat.
V/T = tetap
Sehingga dapat disimpulkan bahwa persamaan tekanan dalam teori kinetik gas adalah :
PV/T = tetap
- Suhu dan Energi Kinetik
Untuk mengetahui temperatur gas dan hubungannya dengan energi kinetik, dapat dilihat bahwa ketika ban dipompa dari luar, maka jumlah partikel gas di dalam ban bertambah. Saat partikel meningkat, tekanan meningkat sementara volume dan suhu gas tetap konstan. Jadi diperoleh:
PV = NKT
Informasi:
P = Tekanan gas (Pa)
V = Volume gas (m³)
N = Jumlah partikel
k = 1,38 x 10ˉ²³ J/K
T = Suhu gas (K)
Untuk gas monoatomik, partikel gas memiliki tiga derajat kebebasan. Untuk menghitung energi kinetik rata-rata partikel gunakan persamaan berikut:
Fk = 3/2 xkxT
Hitung jumlah semua energi kinetik dari banyak partikel gas dengan rumus berikut:
U = 3/2 x N xkx T atau U = 3/2 xnx R x T
- Banyak Tabrakan dengan Tembok
Untuk menghitung jumlah tumbukan atom dengan dinding wadah gas untuk setiap satuan luas per satuan waktu, Anda dapat menggunakan persamaan berikut, dengan asumsi gas memiliki karakteristik ideal:
A = Nxvrata-rata/4 V
- Tingkat RMS molekuler
Kecepatan rata-rata partikel gas sebanding dengan akar kuadrat dari suhu absolut gas. Akar kuadrat dari persamaan rata-rata dikenal sebagai laju RMS atau laju kuadrat akar rata-rata atau kecepatan efektif dengan rumus:
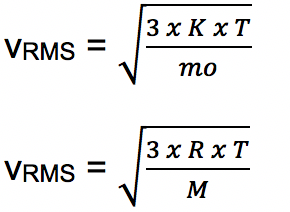
Teori Kinetik Gas dalam Kehidupan Sehari-hari
Air mendidih merupakan salah satu penerapan teori kinetik gas dalam kehidupan sehari-hari. Amati bagaimana kondisi air di dalam wadah air mendidih saat kompor dinyalakan. Mula-mula airnya diam, tetapi ketika mendidih, gelembung udara terbentuk di dalam air.
Pada awal pemasakan, air dalam keadaan stabil dan belum terjadi perpindahan panas. Saat mendidih, partikel air bergerak cepat karena panas yang menyebar dari kompor. Selanjutnya, teko berbunyi bip saat mendidih karena perubahan tekanan.
Es batu yang baru dikeluarkan dari kulkas akan terasa sangat dingin. Namun, es batu lama kelamaan akan mencair bila ditempatkan pada suhu ruangan. Ini terjadi karena suhu es dipengaruhi oleh suhu lingkungan dan memindahkan panas ke es batu dari lingkungan.
Contoh Soal Teori Kinetik Gas
Pada sebuah silinder yang volumenya dapat diubah dengan menaikkan dan menurunkan tutupnya, awalnya volumenya 1,5 L. Tekanannya kemudian diukur pada tekanan 1 atm dengan suhu 27 ⁰C. Ketika tutup tabung ditekan, tekanan gas bertambah menjadi 1,2 atm sedangkan volumenya berkurang menjadi 1,2 L. Tentukan suhunya?
Diskusi
Dikenal:
V1 = 1,5 L
P1 = 1 atm
T1 = 27 ⁰C + 273 = 300 K
V2 = 1,2 L
P2 = 1,2 atm
diminta:
suhu T2?
Menjawab:
P1.V1/T1 = P2.V2/T2
(1 x 1,5)/300 = (1,2 x 1,2)/T2
T2 = 288 K
T2 = 288 – 273 = 15 ⁰C
Dengan mempelajari teori kinetik gas diharapkan kita dapat memahami pengertian gas ideal dan mampu menerapkan ilmu teori kinetik gas dan persamaan gas ideal pada proses isoterm, isobarik dan isokorik dalam kehidupan sehari-hari.
mejakelas.com

Perkenalkan, saya kartiko Seorang penulis asal banyumas, disini saya akan membagikan berbagai artikel yang bermanfaat untuk teman-teman pembaca web pusatdapodik.com




